Time:2020-06-09

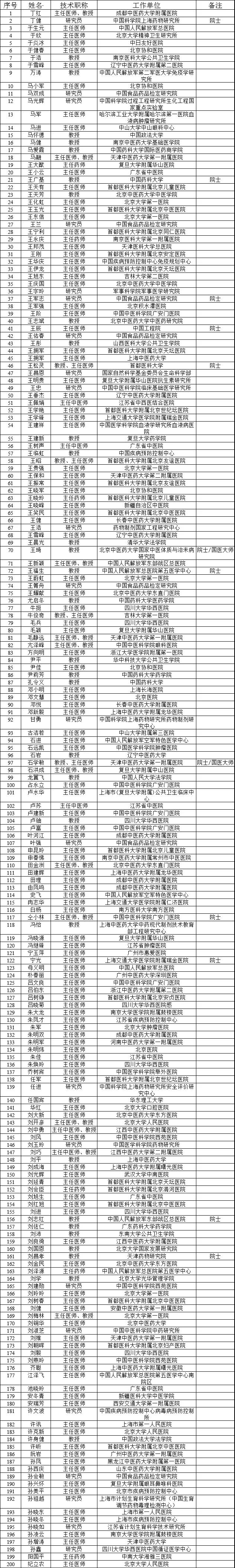
为保障药品审评科学公正,充分发挥专家在药品注册审评决策中的重要作用,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)、《中共中央办公厅 国务院办公厅印发<关于深化审评审批制度改革鼓励药品医疗器械创新的意见>的通知》(厅字〔2017〕42号)以及国家药品监督管理局相关规定,我中心制定了《药品审评中心外聘专家管理办法》(见附件1),经国家药品监督管理局审核同意,现予以发布。
第三十二条 本办法自发布之日起施行。



Scan the WeChat QR code